肺癌是美国最常见的癌症类型之一,仅次于乳腺癌。仅在 2015 年就诊断出 221200 例新肺癌病例,占所有新癌症病例的 13.3%。肺癌是男性和女性癌症死亡的主要原因,占所有癌症死亡人数的 27%,夺走的生命比乳腺癌、结肠癌、前列腺癌和卵巢癌的总和还要多。从 2007 年到 2011 年,肺癌的发病率和死亡率略有下降。
大约 85% 到 90% 的肺癌是非小细胞肺癌 (NSCLC),它包括几个主要亚型,包括鳞状细胞癌、腺癌和大细胞癌。腺癌占所有肺癌病例的 40%,鳞状细胞癌约占 25% 至 30%。4 其他不太常见的 NSCLC 类型包括类癌、多形性、唾液腺癌和未分类癌。
与其他癌症一样,肺癌发现和治疗越早,预后越好。然而,大约 22% 的肺癌病例在诊断时已经局部扩散(到区域淋巴结),57% 已经转移到身体的远处部位。区域转移患者的 5 年相对生存率为 27.4%,而远处转移患者的 5 年相对生存率仅为 4.2%。
转移性 NSCLC 的治疗通常包括化疗、靶向治疗、免疫治疗或这些选择的组合。大多数靶向治疗是针对细胞内靶点设计的小分子化合物,或针对细胞外靶点设计的单克隆抗体。
细胞生物学和基因表达方面的科学进步促进了新靶向疗法的发展,并改变了 NSCLC 治疗的格局。 已经出现了几种预测性生物标志物,这些生物标志物表明特定药物或药物类别对特定 NSCLC 分子靶标的治疗效果。这些生物标志物包括致敏表皮生长因子受体 (EGFR) 突变(例如外显子 19 缺失或外显子 21、L858R 突变)和间变性淋巴瘤激酶 (ALK) 融合基因等。
一些临床指南建议对特定的 NSCLC 患者进行 EGFR 突变和 ALK 基因重排检测。
美国食品和药物管理局 (FDA) 目前批准的 NSCLC 疗法包括 2 种免疫检查点抑制剂纳武单抗和派姆单抗,以及靶向疗法贝伐单抗、雷莫芦单抗、阿法替尼、厄洛替尼、奥希替尼、necitumumab、艾乐替尼、色瑞替尼、和克唑替尼。
分子分析和靶向治疗的不断发展正在改变可用于非小细胞肺癌患者的治疗选择。因此,2015 年是 FDA 批准用于非小细胞肺癌的新疗法的标志性年份。
易瑞沙是 EGFR 突变转移性 NSCLC 的新一线疗法
2015 年 7 月 13 日,FDA 批准吉非替尼(易瑞沙;阿斯利康),一种口服酪氨酸激酶抑制剂,用于转移性 NSCLC 患者的一线治疗,这些患者的肿瘤具有 EGFR 外显子 19 缺失或外显子 21 L848R 取代突变,经检测当天获得FDA批准的therascreen EGFR RGQ PCR Kit。该测试可识别 EGFR 突变,并用于选择吉非替尼治疗的候选者。
外显子 19 缺失和外显子 21 L858R 置换基因突变是最常见的 EGFR 突变类型。表达这些 EGFR 突变的肿瘤与 NSCLC 中的肿瘤细胞生长和转移有关。吉非替尼靶向 EGFR 外显子 19 缺失和外显子 21 L858R 突变。吉非替尼不适用于肿瘤具有除外显子 19 缺失或外显子 21 L858R 替代突变以外的 EGFR 突变的患者。
尽管吉非替尼于 2003 年获得 FDA 批准用于治疗晚期非小细胞肺癌,但由于缺乏证实该药物临床益处的证据,该药物于 2012 年 4 月自愿退出市场。 2015 年 FDA 的新批准是基于吉非替尼对未经治疗的 EGFR 突变阳性 NSCLC 患者的临床益处的证据;吉非替尼获得了针对该适应症的孤儿药指定。
FDA 血液学和肿瘤学产品办公室主任 Richard Pazdur 医学博士说:“易瑞沙为选定的肺癌患者提供了另一种有效的一线治疗选择。这一批准为高度靶向的癌症治疗方法提供了进一步的支持。”
作用机制
吉非替尼是一种酪氨酸激酶抑制剂,可阻断参与具有 EGFR 外显子 19 缺失和外显子 21 L858R 替代突变的癌细胞增殖的蛋白质——2 种 EGFR 激活突变有助于肿瘤细胞生长、血管生成因子和转移。
给药和给药
吉非替尼的推荐剂量为 250 毫克,每日一次,随食物或不随食物一起口服,直至疾病进展或直至出现不可接受的毒性。如果漏服一剂,则不应在漏服后 12 小时内服用。
吉非替尼可作为 250 毫克片剂口服给药。
临床研究
IFUM 临床试验
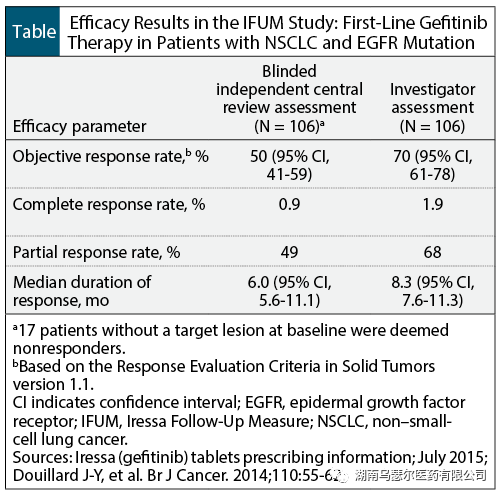
FDA 批准吉非替尼是基于 IRESSA 后续措施 (IFUM) 临床试验的数据,这是一项多中心、单臂、开放标签研究,包括 106 名未经治疗的含有 EGFR 的转移性 NSCLC 患者(中位年龄为 65 岁)外显子 19 缺失或外显子 21 L858R 替换突变。吉非替尼治疗的中位持续时间为 8 个月。
主要疗效终点是客观反应率。次要终点包括反应持续时间、无进展生存期、总生存期以及安全性和耐受性。
根据研究人员的评估,吉非替尼治疗显示出 70% 的客观缓解率,以及基于盲法独立中央审查的 50% 客观缓解率(表)。 EGFR 外显子 19 缺失突变患者的
缓解率与外显子 21 L858R 替代突变患者相似。
IPASS 研究:NSCLC 加 EGFR 突变
IFUM 临床试验的结果得到了易瑞沙泛亚研究 (IPASS) 中患者亚群的探索性分析的支持。IPASS 是一项对 186 名 EGFR 突变阳性 NSCLC 患者进行的随机、多中心、开放标签研究。患者随机接受吉非替尼 250 mg 或卡铂加紫杉醇。
接受吉非替尼治疗的患者的中位无进展生存期为 10.9 个月,而卡铂加紫杉醇治疗组为 7.4 个月(风险比,0.54;95% 置信区间 [CI],0.38-0.79)。吉非替尼的客观缓解率为 67%(95% CI,56-77),而卡铂加紫杉醇的客观缓解率为 41%(95% CI,31-51)。吉非替尼的中位缓解持续时间为 9.6 个月,而卡铂加紫杉醇为 5.5 个月。
不良事件
在一项随机、双盲、安慰剂对照临床试验中评估了吉非替尼治疗的不良反应,该试验涉及每天接受 250 毫克吉非替尼治疗,中位持续时间为 2.9 个月的患者。与吉非替尼治疗相关的所有级别(且大于安慰剂)的最常见(≥10%)不良反应包括皮肤反应(47%)、腹泻(29%)和呕吐(14%)。
吉非替尼报告的最常见(≥2% 且比安慰剂更多)3 级或 4 级不良反应是腹泻 (3%)、食欲下降 (2.3%) 和皮肤反应 (2%)。
大约 5% 的接受吉非替尼治疗的患者因不良反应而停止治疗。导致停用吉非替尼的最常见不良反应是恶心 (0.5%)、呕吐 (0.5%) 和腹泻 (0.4%)。
药物相互作用
细胞色素 (CY) P3A4 诱导剂。对于服用强效CYP3A4诱导剂的患者,吉非替尼的剂量应增加至每天500mg;在停用强效 CYP3A4 诱导剂 7 天后,可恢复 250 毫克剂量。
CYP3A4抑制剂。应监测同时服用强效 CYP3A4 抑制剂和吉非替尼的患者的不良反应。
影响胃酸碱度的药物。如果可能,吉非替尼不应与质子泵抑制剂同时使用。
服用华法林的患者出血。应监测同时服用华法林和吉非替尼的患者凝血酶原时间或国际标准化比率的变化。
警告和注意事项
间质性肺病。吉非替尼治疗有间质性肺病的报道。如果呼吸道症状恶化,应停用吉非替尼,如果确诊为间质性肺病,应停用吉非替尼。
肝毒性。服用吉非替尼的患者应定期进行肝功能检查。肝功能检查异常≥2 级的患者应停用吉非替尼。严重肝功能损害患者应停用吉非替尼。
胃肠道穿孔。如果发生胃肠道穿孔,应永久停用吉非替尼。
腹泻。对于≥3 级腹泻,应停用吉非替尼。
眼部疾病。如果患者出现严重或恶化的眼部疾病症状,包括角膜炎,则应停用吉非替尼。如果发生持续性溃疡性角膜炎,应停用吉非替尼。
大疱性和剥脱性皮肤病。出现严重大疱、水疱或剥脱症状(包括多形性红斑和大疱性皮炎)的患者应中断或停止吉非替尼治疗。
胚胎-胎儿毒性。给孕妇服用吉非替尼可能会对胎儿造成伤害。
在特定人群中使用
怀孕。给孕妇服用吉非替尼可能会对胎儿造成伤害。应建议有生育潜力的女性在吉非替尼治疗期间以及完成吉非替尼治疗后至少 2 周内采取避孕措施。
哺乳期。尚未确定吉非替尼是否会从人乳中排泄。应建议女性在吉非替尼治疗期间停止母乳喂养。
儿科使用。尚未确定吉非替尼在儿科患者中的安全性和有效性。
老年人使用。在年龄 > 65 岁的患者和较年轻的患者之间未观察到吉非替尼的安全性总体差异。12数据不足以确定吉非替尼在这两个年龄组中的疗效是否不同。
肾功能不全。未在严重肾功能损害患者中进行临床试验。
肝功能损害。接受吉非替尼治疗的中度或重度肝功能损害患者应监测不良反应。
结论
FDA 批准口服酪氨酸激酶抑制剂吉非替尼为携带 EGFR 突变的 NSCLC 患者提供了重要的靶向治疗选择。在这部分 EGFR 突变患者中,吉非替尼显示出重要且显着的临床益处,包括 70% 的客观缓解率、8.3 个月的中位缓解持续时间和 50% 的客观缓解率,以及 6 个月的中位缓解率响应持续时间。